Окислительно восстановительные реакции видео
Окислительно восстановительные реакции видео
Письмо с инструкцией по восстановлению пароля
будет отправлено на вашу почту
- Главная
- 8-Класс
- Химия
- Видеоурок «Окислительно-восстановительные реакции»
Мы уже знаем, что при образовании ионной химической связи между атомами разных по характеру элементов происходит полное или частичное перемещение валентных электронов к более электроотрицательному атому с образованием ионов.
Для обозначения их истинного или условного заряда в соединении введено понятие «степень окисления».
Напомню, что степень окисления– это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
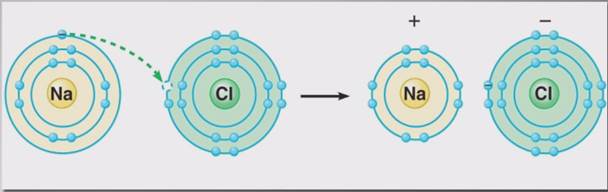
В ионных соединениях степень окисления отражает истинный заряд ионов, что связано с переходом электронов от атомов металла к атомам неметалла, как, например, при образовании хлорида натрия. Отдав свой электрон атому хлора, атом натрия приобретает положительный заряд и превращается в катион натрия Na+. Атом хлора, приобретая электрон натрия, приобретает отрицательный заряд, превращаясь в хлорид-анион Cl-.
Образование ионной связи можно представить в виде двух процессов.

Первый – отдача электрона атомом натрия и превращение его в катион натрия – это окисление. Второй – присоединение электрона атомом хлора и превращение его в хлорид-анион – это восстановление.
Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
Эти два процесса взаимосвязаны, так как электроны от одного атома переходят к другому атому. В обоих случаях это приводит к образованию устойчивых электронных структур.
Вещество, в состав которого входят атомы элемента, способного отдавать электроны, то есть повышать степень окисления, называется восстановителем. К восстановителям относятся атомы и простые вещества – металлы, молекулярный водород, сероводород, аммиак, оксид углерода (II) и другие. В процессе отдачи электронов восстановитель окисляется.
Вещество, в состав которого входят атомы элемента, способного притягивать электроны, то есть понижать степень окисления, называется окислителем.
Окислитель (галогены, кислород, кислоты и другие вещества) в этом процессе восстанавливается.
Восстановитель (металлы, водород, углерод и другие) окисляется.
Поместим 1-2 гранулы цинка в пробирку и добавим несколько мл соляной кислоты. На поверхности цинка образуются пузырьки газа, которые быстро поднимаются вверх. Этот газ – водород. Цинк постепенно растворится, превратившись в растворимый хлорид цинка. Zn + 2HCl→ZnCl2 + H2↑.
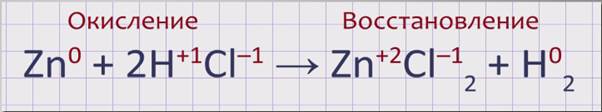
Расставим степени окисления над формулами веществ, участвующих в реакции. Степень окисления цинка в простом веществе цинк равна 0, в соляной кислоте водород имеет степень окисления +1, хлор -1. В хлориде цинка степень окисления цинка +2, хлора -1. Степень окисления водорода в простом веществе водород равна 0.
Zn0 + 2H+1Cl-1→ Zn+2Cl-12 + H02.
В данной реакции происходят два процесса. Первый, окисление – отдача электронов атомом цинка, восстановителем и приобретение им степени окисления +2. Второй, восстановление – присоединение электронов атомами водорода, окислителем и превращение их в нейтральную молекулу водорода.
В этих реакциях процессы окисления и восстановления взаимосвязаны. Особенность таких реакций заключается в том, что, кроме разрушения старых связей в исходных веществах и образования новых в продуктах реакции, происходит изменение степеней окисления атомов реагирующих веществ.
Реакции, сопровождающиеся изменением степени окисления атомов элементов, называются окислительно-восстановительными.
Изменение степени окисления атомов элементов в ходе превращения веществ – важнейший признак окислительно-восстановительных реакций, по которому они распознаются и выделяются среди других.
Окислительно-восстановительные реакции, как и другие реакции, подчиняются общему закону природы – закону сохранения массы и энергии.
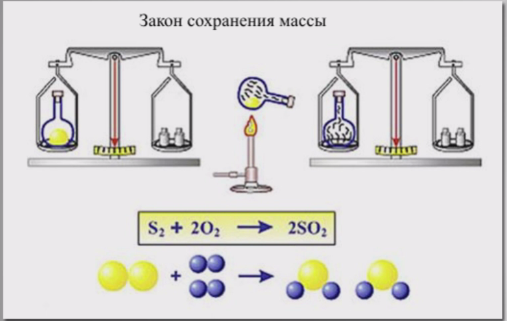
Конкретное его проявление в окислительно-восстановительных реакциях заключено в сохранении числа электронов в реакционной системе, то есть число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Для окислительно-восстановительных реакций характерны специфические закономерности протекания:
1.единство, неразрывность окислительного и восстановительного процессов в реакциях данного вида;
2.сохранение числа электронов в системе.
Химическое уравнение является моделью реальной химической реакции. Химическая реакция и ее уравнение отражают закон сохранения массы веществ.
В химии важно владеть языком формул и уравнений, которые в краткой и обзорной форме отражают закономерности состава и строения веществ, сущность и закономерности протекания химических реакций. Теория окислительно-восстановительных процессов включает их уравнения, требующие своеобразного оформления и умения их составлять.
При составлении уравнений окислительно-восстановительных реакций следует опираться на изученные ранее закономерности их протекания, умение отличать окислительно-восстановительные реакции от других реакций. В основе их составления лежит молекулярное уравнение.
Для составления уравнений окислительно-восстановительных реакций надо учитывать неразрывность окисления и восстановления и сохранение при этом числа электронов, то есть опираться на следующее правило. Число электронов, оттянутых восстановителем, должно быть равно числу электронов, притянутых окислителем.
Составление уравнения окислительно-восстановительных реакций и расстановка в нём коэффициентов – достаточно сложные действия.
Расставлять коэффициенты в уравнениях сложных окислительно-восстановительных реакций путем их подбора, как это делали ранее, дело не только трудное, но часто и невозможное.
Упростить расстановку коэффициентов в уравнениях помогает метод электронного баланса. Он основан на правиле сохранения числа электронов в системе, отражающем суть метода.
Познакомимся с алгоритмом расстановки коэффициентов в уравнениях окислительно-восстановительных реакций.

Определяем тип реакции по изменению степени окисления атомов элементов. Степени окисления изменяются – реакция окислительно-восстановительная. Записываем процессы окисления и восстановления, указываем окислитель и восстановитель. Уравниваем число электронов в процессах окисления и восстановления, ставим коэффициенты перед формулами соответствующих веществ. Уравниваем количество остальных атомов.
Окислительно-восстановительные реакции
На уроке рассматривается сущность окислительно-восстановительных реакций, их отличие от реакций ионного обмена. Объясняются изменения степеней окисления окислителя и восстановителя. Вводится понятие электронного баланса.
Тема: Окислительно-восстановительные реакции
Урок: Окислительно-восстановительные реакции
1. Понятие «окислительно-восстановительные реакции»
Рассмотрим реакцию магния с кислородом. Запишем уравнение этой реакции и расставим значения степеней окисления атомов элементов:

Как видно, атомы магния и кислорода в составе исходных веществ и продуктов реакции имеют различные значения степеней окисления. Запишем схемы процессов окисления и восстановления, происходящих с атомами магния и кислорода.
До реакции атомы магния имели степень окисления, равную нулю, после реакции — +2. Таким образом, атом магния потерял 2 электрона:

Магний отдает электроны и сам при этом окисляется, значит, он является восстановителем.
До реакции степень окисления кислорода была равна нулю, а после реакции стала -2. Таким образом, атом кислорода присоединил к себе 2 электрона:

Кислород принимает электроны и сам при этом восстанавливается, значит, он является окислителем.
Запишем общую схему окисления и восстановления:

Число отданных электронов равно числу принятых. Электронный баланс соблюдается.
2. Отличие окислительно-восстановительных реакций от реакций ионного обмена
В окислительно-восстановительных реакциях происходят процессы окисления и восстановления, а значит, меняются степени окисления химических элементов. Это отличительный признак окислительно-восстановительных реакций.
Окислительно-восстановительными называют реакции, в которых химические элементы изменяют свою степень окисления
3. Изменение степеней окисления окислителя и восстановителя
Рассмотрим на конкретных примерах, как отличить окислительно-восстановительную реакцию от прочих реакций.
1. NaOH + HCl = NaCl + H2O
Для того чтобы сказать, является ли реакция окислительно-восстановительной, необходимо расставить значения степеней окисления атомов химических элементов.
1. NaOH + HCl = NaCl + H2O
Обратите внимание, степени окисления всех химических элементов слева и справа от знака равенства остались неизменными. Значит, эта реакция не является окислительно-восстановительной.
В результате данной реакции степени окисления углерода и кислорода поменялись. Причем углерод повысил свою степень окисления, а кислород понизил. Запишем схемы окисления и восстановления:
С -8е =С — процесс окисления
О +2е = О — процесс восстановления
Чтобы число отданных электронов было равно числу принятых, т.е. соблюдался электронный баланс, необходимо домножить вторую полуреакцию на коэффициент 4:
С -8е =С — восстановитель, окисляется
О +2е = О 4 окислитель, восстанавливается
Окислитель в ходе реакции принимает электроны, понижая свою степень окисления, он восстанавливается.
Восстановитель в ходе реакции отдает электроны, повышая свою степень окисления, он окисляется.
Список рекомендованной литературы
1. Микитюк А.Д. Сборник задач и упражнений по химии. 8-11 классы / А.Д. Микитюк. – М.: Изд. «Экзамен», 2009. (с.67)
2. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§22)
3. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§5)
4. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с.54-55)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с.70-77)
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
2. Единая коллекция цифровых образовательных ресурсов (интерактивные задачи по теме) (Источник).
3. Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
1. №10.40 – 10.42 из «Сборника задач и упражнений по химии для средней школы» И.Г. Хомченко, 2-е изд., 2008 г.
2. Участие в реакции простых веществ – верный признак окислительно-восстановительной реакции. Объясните почему. Напишите уравнения реакций соединения, замещения и разложения с участием кислорода О2.
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 

Окислительно Восстановительные Реакции
Окислительно-восстановительные реакции. Электронный баланс.
Составление уравнений окислительно-восстановительных реакций. Метод электронного баланса. Окислитель.
Окислительно-восстановительные реакции. Видеоурок по химии 9 класс
Пройти тест по теме: https://goo.gl/kBrKAr Перейти к тренажерам: https://goo.gl/5qk4wx Домашнее задание от Домашней Школы InternetUro.
Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.
Пример составления окислительно-восстановительной реакции в кислой среде при помощи алгоритма. Упрощенны.
66. Окислительно-восстановительные реакции.
В этом уроке мы рассмотрим что такое окислительно-восстановительные реакции и научимся определять окисли.
Окислительно-восстановительные реакции
Бесплатные онлайн-занятия каждую неделю ☺ Чтобы участвовать в них, нужно перейти по ссылке, которую.
Окислительно-восстановительные реакции (ОВР). Что надо знать и как их решать
ОВР — одна из самых сложных тем в химии. Разберемся, как можно их решать и, то нам для этого нужно. Данный мате.
Окислительно восстановительные реакции | Химия 8 класс #52 | Инфоурок
Видеоуроки являются идеальными помощниками при изучении новых тем, закреплении материала, для обычных.
Окислительно-восстановительные реакции. Метод электронного баланса. ЕГЭ
Уравнивание ОВР методом электронного баланса. ЕГЭ. Ссылки на дополнительные видео: 1) ОВР Метод электронно-и.
89. Как расставить коэффициенты реакции методом электронного баланса (закрепление)
Что такое степень окисления https://youtu.be/zJhm06SrxQ0 Как определять степени окисления элементов в соединениях.
Окислительно-восстановительные реакции. Часть 1.
На этом уроке дается понятие о процессах окисления и восстановления, типичных окислителях и восстановител.
Габриелян О. С. 8 класс §44 «Окислительно-восстановительные реакции».
Габриелян О. С. 8 класс §44 «Окислительно-восстановительные реакции». ВНИМАНИЕ! Одна из ключевых тем в ЕГЭ.
Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.
Пример составления окислительно-восстановительной реакции в кислой среде при помощи алгоритма. Продвинут.
ОГЭ химия 2019 за 7 уроков. 5/7 (окислительно-восстановительные реакции)
Канал репетитора по химии Андрея Степенина — https://www.youtube.com/user/astepenin ************************************************************* #ОГЭхим.
Окислительно-восстановительные реакции (ОВР)
Видео-подготовка к ЦТ и ЕГЭ по химии http://www.yoursystemeducation.com Экспресс-подготовка к ЦТ и ЕГЭ по химии в контакте.
ОВР: как решать быстро и правильно | ХИМИЯ ЕГЭ | Лия Менделеева
Хочешь больше полезных таблиц, шпаргалок и видео по химии? Тогда вступай в нашу группу ВКонтакте: https://urlgeni.us.
Химия | Окислительно-восстановительные реакции
Записывайтесь на уроки к лучшим репетиторам: http://bit.ly/2tBHeEB Открытый урок в режиме реального времени. Трансля.
Учимся составлять электронный баланс/овр/8класс
В видео предложен порядок действий расстановки коэффициентов методом электронного баланса.
Окислительно-восстановительные реакции. Метод электронно-ионного баланса.
Решаем примеры ОВР методом электронно-ионного баланса (практика). Расстановка коэффициентов. Ссылки на.
Химия 11 класс : Окислительно-восстановительные реакции
Больше видеоуроков на https://onliskill.ru/ Это химические реакции, сопровождающиеся изменением степени окисления.
Химия, 9 класс, тема «Окислительно-восстановительные реакции» (учитель Швецова Елена Евгеньевна)
Окислительно восстановительные реакции, часть 1 из 4. Определение степеней окисления.
Часть 1. «Определение степеней окисления». Разбор задач от дистанционных курсов подготовки абитуриентов.
Шеховцова Т.Н. — Аналитическая химия — Окислительно-восстановительные реакции
0:00:10 1. Окислительно-восстановительные реакции. Электрохимическая ячейка 0:17:35 2. Стандартный водородный.
Составление ОВР методом электронного баланса
в видеофрагменте представлен пример составления ОВР.
Окислительно-восстановительные реакции простым языком | Химия ОГЭ | Умскул
Если хочешь записаться в Мастер-Группу или узнать подробнее, пиши СЛОВО мне в сообщения: https://vk.com/chemistry_vlad.
Химические свойства соединений марганца Mn (+7). Решаем окислительно-восстановительные реакции.
ОВР с соединениями марганца (+7). Алгоритм решения и примеры решения ОВР с участием марганца (+7). Видео по.
Окислительно-восстановительные реакции. Основные понятия и классификация с примерами.
Окислительно-восстановительные реакции и их классификация. Краткая теория с примерами на практике. Ссылки.
Окислительно-восстановительные реакции на примере алкенов (ОВР). ЕГЭ по химии
Расписание вебинаров: http://stepenin.ru/webinars/ Составление и уравнивание ОВР (окислительно-восстановительных реакц.
Окислительно восстановительные реакции. Электролиз | Химия 11 класс #19 | Инфоурок
Видеоуроки являются идеальными помощниками при изучении новых тем, закреплении материала, для обычных.
§43, 8кл. Окислительно-восстановительные реакции
Тема: «Окислительно-восстановительные реакции» (Темы по учебнику Химия, 8 класс, автора Габриелян О.С.). Автор.
ОВР часть 3: Типы окислительно-восстановительных реакций, какие бывают окислители и восстановители
Видео о типах окислительно-восстановительных реакций. Репетитор по химии рассказывает, как размышлять.
Окислительно-восстановительные реакции. Сложные случаи электронного баланса.
Подробный разбор сложных случаев ОВР с двумя окислителями или восстановителями (метод электронного баланс.
Окислительно-восстановительные реакции часть 1: Степени окисления
Серия видео уроков по окислительно-восстановительным реакциям. Я решила начать со степеней окисления.
Частая ошибка. Электронный баланс | ЕГЭ Химия | Лия Менделеева
Разобрала для вас распространенные ошибки учеников и абитуриентов. О себе: — выпустили 117-стобалльников.
Химия 8 класс (Урок№33 — Окислительно-восстановительные реакции.)
Химия 8 класс Урок№33 — Окислительно-восстановительные реакции. Сегодня мы рассмотрим, как изменяются степе.
Окислительно восстановительная реакция ОГЭ
Окислительно-восстановительные реакции. Опыт 1
Опыты по химии. Тема «Окислительно-восстановительные реакции» (каф. Химия) Опыты по химии входят в учебные.
ОВР в ЕГЭ по химии. Задания 30, 31. Разбор вариантов ЕГЭ от Добротина
Разбор окислительно-восстановительных реакций (ОВР) из задания №30 ЕГЭ по химии. На примере 15 варианта из.
Окислительно-восстановительные реакции часть 2: метод электронного баланса
Второй урок по окислительно-восстановительным реакциям. Рассказываю, что это такое и как расставлять коэфф.
Окислительно восстановительные реакции
Химия, 8 класс. Понятия: ОВР, окислитель, восстановитель, окисление, восстановление. Расстановка коэффициент.
Окислительно-восстановительные реакции в щелочноной среде. Упрощенный подход.
Пример составления окислительно-восстановительной реакции в нейтральной среде при помощи алгоритма. Упро.
Как определить продукты в окислительно-восстановительных реакциях. Ч.1. Введение.
Окислительно-восстановительные реакции (ОВР). Учимся составлять уравнения. Знакомимся с главными особенно.
Окислительно-восстановительные реакции. ЕГЭ по химии
Подготовка к ЕГЭ по химии. Окислительно-восстановительные реакции. Находим окислитель и восстановитель.
ОВР часть 1. Окислительно-восстановительные реакции. Алгоритм
Алгоритм и картиночки тут: https://drive.google.com/open?id=1th9cqpx6vam0a8z68esRN4Vg1NuBZFZn Паблик в вк: https://vk.com/chemistrynaeasy.
§40, 9 кл. Окислительно-восстановительные реакции
Тема: «Окислительно-восстановительные реакции» Химия. 9 класс» автора Габриелян О.С.). Автор урока Вурдиханов.
ОВР часть 2. Окислительно-восстановительные реакции. Электродный потенциал.
Таблица электродных потенциалов: http://www.chem.msu.su/rus/handbook/redox/welcome.html Учим химию в вк: https://vk.com/chemistrynaeasy.
Окислительно-восстановительные реакции. Опыт 4
Опыты по химии. Тема «Окислительно-восстановительные реакции» (каф. Химия) Опыты по химии входят в учебные.
Окислительно-восстановительные реакции. [ChemistryToday]
В данном ролике мы разобрали, что такое степень окисления, заряд и ОВР, а также научились их уравнивать с.
Окислительно-восстановительные реакции в нейтральной среде. Продвинутый подход.
Пример составления окислительно-восстановительной реакции в нейтральной среде при помощи алгоритма. Прод.
Ерёмин В. В. — Общая химия — Окислительно-восстановительные реакции (Лекция 6)
1. Окислительно-восстановительные реакции 1.1. Окислители 1.2. Восстановители 1.3. Способы определения продукт.
Химия 9 класс (Урок 1 — Окислительно-восстановительные реакции)
Химия 9 класс Урок 1. Окислительно-восстановительные реакции. Реакции соединения, разложения, замещения.

Мои Глупые Поступки Достали Соседа (анимация)

Зулейха открывает глаза. 5 серия (2020) Драма, экранизация @ Россия 1

Непосредственно Каха — «Назад в будущее

Егор Крид, Гарик Харламов и Тимур Батрутдинов. Ошуительное Хоу

DIY — Балкон дезинфектор

ПИРОГ из 10 видов МЯСА! (эксперимент)

СПАСАЮТ ЛИ МАСКИ ОТ ВИРУСА?

Поиск авто за 200тр на автомате.

Шоу Иды Галич 1-11. Квиз, плиз!

Японская трасса в центре России (прыжок в стену)

ПЛОХИЕ ПЕСНИ №6 КЛАВА КОКА против СТАСА ЯРУШИНА

Apple представила новый iPhone SE на A13 Bionic — он пришел чтоб унижать в 2020. Первый взгляд.

КОНТАКТЫ в телефоне Егора Крида: Нюша, Киркоров, ASAP Rocky, Президент Молдавии

Обзор фильма Оно 2 (Провал клоунады) — KinoKiller

ДЫБИЛЬНАЯ СЕМЕЙКА — КАРАНТИН
Хотите хорошо провести время за просмотром видео? На нашем видео портале вы найдете видеоролики на любой вкус, смешные видео, видео о животных, видео трансляции и многое другое
Топ Альбомы












Слушают
Birthday Suit Cosmo Sheldrake
Magnat Bespredel Scaciati Mp3
Папа Вел Меня В Землю
Damien Hendrix Glow
Rahman Hudayberdiyew 2019
А Я Девчонка Со Двора И Дочь Старого Вора
Lino Golden Medusa
Ламборгини Против Истребителя
Mike Dope G Street
Gowşut Saryýew Uzak Ýollarda Mp3
Jah Khalib Колыбельная 8D Скачать
Скачивают
Million Jamoasi Konsert Dasturi 2016 Full Hd
Новогодний Bass Test 1
Top 15 Meme Brawl Stars
Graffiti Ghost Ea Tags Throws Dubs
The Lion King 1994 2019 Mufasa S Death Long Live The King
Loboda Танцую Волосами Воронеж
Видео От Дулина Дмитрия Нас Тянет К Тем Кто Душу Обнимает
Patir Non Bu Patirlarni Yoqtirmaydigan Inson Topilmasa Kerak
Usafirishaji Wa Mizigo Kwa Treni Umeanza Rasmi Bandari Ya Mwanza South
Kutibu Chunusi Na Makovu Ya Chunusi Na Kuondoa Makunyanzi Usoni
Мой Кайф Мой Сон Полёт И Унисон Remix By Hak2Kk4
Любовь Ушла New Version 2018
Травертинлар Ва Абой Паталокларнинг Янги Фасонлари Travertinlar Va Aboy Pataloklarninh Yangi Fason
Отель Хазбин Русская Озвучка 3 Hazbin Hotel Rus Translation 3
Deltarune Песня Джевила Безумная Карусель
2 Hombre Y 1 Mujer Gacha Life Melanin Kawaii Parte 4
Strangerland Calling You
Morning Flower Bassboosted
Un Tableau Abstrait En 10 Minutes Par Nelly Lestrade
Lola Remedios First Impression Review Gamot Sa Lamig Ng Katawan



