Видео окислительно восстановительные реакции
Видео окислительно восстановительные реакции
Письмо с инструкцией по восстановлению пароля
будет отправлено на вашу почту
- Главная
- 8-Класс
- Химия
- Видеоурок «Окислительно-восстановительные реакции»
Мы уже знаем, что при образовании ионной химической связи между атомами разных по характеру элементов происходит полное или частичное перемещение валентных электронов к более электроотрицательному атому с образованием ионов.
Для обозначения их истинного или условного заряда в соединении введено понятие «степень окисления».
Напомню, что степень окисления– это условный заряд атома в химическом соединении, если предположить, что оно состоит из ионов.
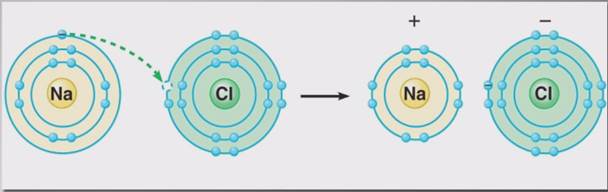
В ионных соединениях степень окисления отражает истинный заряд ионов, что связано с переходом электронов от атомов металла к атомам неметалла, как, например, при образовании хлорида натрия. Отдав свой электрон атому хлора, атом натрия приобретает положительный заряд и превращается в катион натрия Na+. Атом хлора, приобретая электрон натрия, приобретает отрицательный заряд, превращаясь в хлорид-анион Cl-.
Образование ионной связи можно представить в виде двух процессов.

Первый – отдача электрона атомом натрия и превращение его в катион натрия – это окисление. Второй – присоединение электрона атомом хлора и превращение его в хлорид-анион – это восстановление.
Окислением называется процесс отдачи электронов атомом, молекулой или ионом.
Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом.
Эти два процесса взаимосвязаны, так как электроны от одного атома переходят к другому атому. В обоих случаях это приводит к образованию устойчивых электронных структур.
Вещество, в состав которого входят атомы элемента, способного отдавать электроны, то есть повышать степень окисления, называется восстановителем. К восстановителям относятся атомы и простые вещества – металлы, молекулярный водород, сероводород, аммиак, оксид углерода (II) и другие. В процессе отдачи электронов восстановитель окисляется.
Вещество, в состав которого входят атомы элемента, способного притягивать электроны, то есть понижать степень окисления, называется окислителем.
Окислитель (галогены, кислород, кислоты и другие вещества) в этом процессе восстанавливается.
Восстановитель (металлы, водород, углерод и другие) окисляется.
Поместим 1-2 гранулы цинка в пробирку и добавим несколько мл соляной кислоты. На поверхности цинка образуются пузырьки газа, которые быстро поднимаются вверх. Этот газ – водород. Цинк постепенно растворится, превратившись в растворимый хлорид цинка. Zn + 2HCl→ZnCl2 + H2↑.
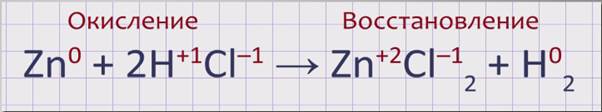
Расставим степени окисления над формулами веществ, участвующих в реакции. Степень окисления цинка в простом веществе цинк равна 0, в соляной кислоте водород имеет степень окисления +1, хлор -1. В хлориде цинка степень окисления цинка +2, хлора -1. Степень окисления водорода в простом веществе водород равна 0.
Zn0 + 2H+1Cl-1→ Zn+2Cl-12 + H02.
В данной реакции происходят два процесса. Первый, окисление – отдача электронов атомом цинка, восстановителем и приобретение им степени окисления +2. Второй, восстановление – присоединение электронов атомами водорода, окислителем и превращение их в нейтральную молекулу водорода.
В этих реакциях процессы окисления и восстановления взаимосвязаны. Особенность таких реакций заключается в том, что, кроме разрушения старых связей в исходных веществах и образования новых в продуктах реакции, происходит изменение степеней окисления атомов реагирующих веществ.
Реакции, сопровождающиеся изменением степени окисления атомов элементов, называются окислительно-восстановительными.
Изменение степени окисления атомов элементов в ходе превращения веществ – важнейший признак окислительно-восстановительных реакций, по которому они распознаются и выделяются среди других.
Окислительно-восстановительные реакции, как и другие реакции, подчиняются общему закону природы – закону сохранения массы и энергии.
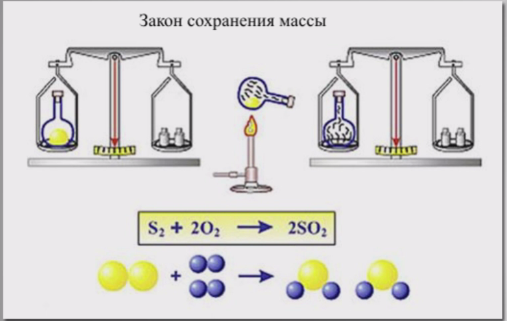
Конкретное его проявление в окислительно-восстановительных реакциях заключено в сохранении числа электронов в реакционной системе, то есть число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Для окислительно-восстановительных реакций характерны специфические закономерности протекания:
1.единство, неразрывность окислительного и восстановительного процессов в реакциях данного вида;
2.сохранение числа электронов в системе.
Химическое уравнение является моделью реальной химической реакции. Химическая реакция и ее уравнение отражают закон сохранения массы веществ.
В химии важно владеть языком формул и уравнений, которые в краткой и обзорной форме отражают закономерности состава и строения веществ, сущность и закономерности протекания химических реакций. Теория окислительно-восстановительных процессов включает их уравнения, требующие своеобразного оформления и умения их составлять.
При составлении уравнений окислительно-восстановительных реакций следует опираться на изученные ранее закономерности их протекания, умение отличать окислительно-восстановительные реакции от других реакций. В основе их составления лежит молекулярное уравнение.
Для составления уравнений окислительно-восстановительных реакций надо учитывать неразрывность окисления и восстановления и сохранение при этом числа электронов, то есть опираться на следующее правило. Число электронов, оттянутых восстановителем, должно быть равно числу электронов, притянутых окислителем.
Составление уравнения окислительно-восстановительных реакций и расстановка в нём коэффициентов – достаточно сложные действия.
Расставлять коэффициенты в уравнениях сложных окислительно-восстановительных реакций путем их подбора, как это делали ранее, дело не только трудное, но часто и невозможное.
Упростить расстановку коэффициентов в уравнениях помогает метод электронного баланса. Он основан на правиле сохранения числа электронов в системе, отражающем суть метода.
Познакомимся с алгоритмом расстановки коэффициентов в уравнениях окислительно-восстановительных реакций.

Определяем тип реакции по изменению степени окисления атомов элементов. Степени окисления изменяются – реакция окислительно-восстановительная. Записываем процессы окисления и восстановления, указываем окислитель и восстановитель. Уравниваем число электронов в процессах окисления и восстановления, ставим коэффициенты перед формулами соответствующих веществ. Уравниваем количество остальных атомов.
Окислительно-восстановительные реакции
На уроке рассматривается сущность окислительно-восстановительных реакций, их отличие от реакций ионного обмена. Объясняются изменения степеней окисления окислителя и восстановителя. Вводится понятие электронного баланса.
Тема: Окислительно-восстановительные реакции
Урок: Окислительно-восстановительные реакции
1. Понятие «окислительно-восстановительные реакции»
Рассмотрим реакцию магния с кислородом. Запишем уравнение этой реакции и расставим значения степеней окисления атомов элементов:

Как видно, атомы магния и кислорода в составе исходных веществ и продуктов реакции имеют различные значения степеней окисления. Запишем схемы процессов окисления и восстановления, происходящих с атомами магния и кислорода.
До реакции атомы магния имели степень окисления, равную нулю, после реакции — +2. Таким образом, атом магния потерял 2 электрона:

Магний отдает электроны и сам при этом окисляется, значит, он является восстановителем.
До реакции степень окисления кислорода была равна нулю, а после реакции стала -2. Таким образом, атом кислорода присоединил к себе 2 электрона:

Кислород принимает электроны и сам при этом восстанавливается, значит, он является окислителем.
Запишем общую схему окисления и восстановления:

Число отданных электронов равно числу принятых. Электронный баланс соблюдается.
2. Отличие окислительно-восстановительных реакций от реакций ионного обмена
В окислительно-восстановительных реакциях происходят процессы окисления и восстановления, а значит, меняются степени окисления химических элементов. Это отличительный признак окислительно-восстановительных реакций.
Окислительно-восстановительными называют реакции, в которых химические элементы изменяют свою степень окисления
3. Изменение степеней окисления окислителя и восстановителя
Рассмотрим на конкретных примерах, как отличить окислительно-восстановительную реакцию от прочих реакций.
1. NaOH + HCl = NaCl + H2O
Для того чтобы сказать, является ли реакция окислительно-восстановительной, необходимо расставить значения степеней окисления атомов химических элементов.
1. NaOH + HCl = NaCl + H2O
Обратите внимание, степени окисления всех химических элементов слева и справа от знака равенства остались неизменными. Значит, эта реакция не является окислительно-восстановительной.
В результате данной реакции степени окисления углерода и кислорода поменялись. Причем углерод повысил свою степень окисления, а кислород понизил. Запишем схемы окисления и восстановления:
С -8е =С — процесс окисления
О +2е = О — процесс восстановления
Чтобы число отданных электронов было равно числу принятых, т.е. соблюдался электронный баланс, необходимо домножить вторую полуреакцию на коэффициент 4:
С -8е =С — восстановитель, окисляется
О +2е = О 4 окислитель, восстанавливается
Окислитель в ходе реакции принимает электроны, понижая свою степень окисления, он восстанавливается.
Восстановитель в ходе реакции отдает электроны, повышая свою степень окисления, он окисляется.
Список рекомендованной литературы
1. Микитюк А.Д. Сборник задач и упражнений по химии. 8-11 классы / А.Д. Микитюк. – М.: Изд. «Экзамен», 2009. (с.67)
2. Оржековский П.А. Химия: 9-й класс: учеб. для общеобраз. учрежд. / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. – М.: АСТ: Астрель, 2007. (§22)
3. Рудзитис Г.Е. Химия: неорган. химия. Орган. химия: учеб. для 9 кл. / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§5)
4. Хомченко И.Д. Сборник задач и упражнений по химии для средней школы. – М.: РИА «Новая волна»: Издатель Умеренков, 2008. (с.54-55)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003. (с.70-77)
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов (видеоопыты по теме) (Источник).
2. Единая коллекция цифровых образовательных ресурсов (интерактивные задачи по теме) (Источник).
3. Электронная версия журнала «Химия и жизнь» (Источник).
Домашнее задание
1. №10.40 – 10.42 из «Сборника задач и упражнений по химии для средней школы» И.Г. Хомченко, 2-е изд., 2008 г.
2. Участие в реакции простых веществ – верный признак окислительно-восстановительной реакции. Объясните почему. Напишите уравнения реакций соединения, замещения и разложения с участием кислорода О2.
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 

Окислительно-восстановительные реакции
Для просмотра онлайн кликните на видео ⤵

Окислительно-восстановительные реакции. Электронный баланс. Подробнее

Окислительно-восстановительные реакции (ОВР). Что надо знать и как их решать Подробнее

66. Окислительно-восстановительные реакции. Подробнее

Габриелян О. С. 8 класс §44 «Окислительно-восстановительные реакции». Подробнее

Окислительно-восстановительные реакции. Видеоурок по химии 9 класс Подробнее

Окислительно восстановительные реакции | Химия 8 класс #52 | Инфоурок Подробнее

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход. Подробнее

Окислительно-восстановительные реакции. Метод электронного баланса. ЕГЭ Подробнее

89. Как расставить коэффициенты реакции методом электронного баланса (закрепление) Подробнее

Разбор ОВР из ОГЭ по химии | EASY PEASY Подробнее

Окислительно-восстановительные реакции. Метод электронно-ионного баланса. Подробнее

Химические уравнения. Как составлять химические уравнения. Подробнее

Определение степени окисления.flv Подробнее

Поступил в медицинский? УЗНАЙ, ЧТО ТЕБЯ ЖДЕТ | 1 МЕД Подробнее

Учимся составлять электронный баланс/овр/8класс Подробнее

Составление ОВР методом электронного баланса Подробнее

Химия, 9 класс, тема «Окислительно-восстановительные реакции» (учитель Швецова Елена Евгеньевна) Подробнее

Окислительно-восстановительные реакции (ОВР) Подробнее

Окислительно-восстановительные реакции. Часть 1. Подробнее
Как?! Вы до сих пор не умеете писать ОВР?! Я вас научу! 9.1 Кто вы, господа окислители и восстановители?
Вы хотите познавать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
Сегодня — особенный день. «И что же в нем такого необычного?» — спросите вы. Отвечаю. Я, наконец-то, добралась до моего самого любимого царства-королевства, до моих конфет и пирожных, малинок и клубничек! Окислительно-восстановительные реакции! Вы даже не представляете, насколько это интересно!
Мои ученики в процессе подготовки к экзамену по химии, проходят несколько стадий вызревания. Первое серьезное испытание на прочность — газы ! Это из серии «гестапо отдыхает» . Решив огромное количество газовых задач, по сравнению с которыми 28-е задачи ЕГЭ — детский лепет, народ полностью структурирует свой мозг и настраивает мышление на профессиональное восприятие химии по-взрослому .
Вторая ступень химической зрелости и мудрости — окислительно-восстановительные реакции . Они приучают к усидчивости и внимательности. Набравшись опыта в написании ОВР, ребята начинают чувствовать себя ломоносовыми , клапейронами и менделеевыми в одном флаконе. За спиной вырастают крылья и. понеслось! Дальнейшее изучение химии проходит на едином дыхании, профессиональный рост — в геометрической прогрессии. На этой стадии мои ученики уже могут заткнуть за пояс каждого второго школьного преподавателя химии!
Понимая всю серьезность материала статьи, я отключила мобильную связь с внешним миром — с Карлсоном, Алисой (которая из страны Чудес), Сири, Фрекен Бок (тем более, что она работает химичкой в школе, где учится Малыш) и всеми остальными озорниками и хулиганами. Оставила только астральную связь для служебного пользования . Возможно, музы на чаек залетят или еще кто-нибудь забредет. А мы с вами займемся самым интересным делом — будем раскладывать по полочкам все накопленные мною знания по теории и практике окислительно-восстановительных реакций . Долго будем этим заниматься. Пока не надоест. Итак, поехали!
Окислительно-восстановительные реакции (ОВР) — химические реакции, в результате которых происходит изменение степеней окисления элементов.
ОВР протекают с участием двух участников — окислителя и восстановителя , и состоят из двух противоположных процессов:
1) Окисление — процесс отдачи электронов (восстановитель отдает электроны окислителю, восстановитель окисляется — окислитель восстанавливается).
2) Восстановление — процесс присоединения электронов (окислитель присоединяет электроны от восстановителя, окислитель восстанавливается — восстановитель окисляется).
Кто же вы, господа окислители и восстановители? Как вас узнать среди огромного количества химических веществ? Сегодня разберем самые общие характеристики участников ОВР (окислителей и восстановителей) на отдельных примерах. После изучения технологии написания ОВР (в следующей статье), поработаем с целыми семействами окислителей и восстановителей, с неорганическими и органическими веществами, проводя реакции в разных средах. А пока — читаем внимательно!
Окислитель — атом в составе молекулы или иона, который присоединяет электроны от восстановителя. Происходит процесс восстановления окислителя (его степень окисления снижается).
Окислительная активность — способность атома отбирать электроны у других атомов.
Окислительно-восстановительный потенциал (редокс-потенциал) — показатель окислительной активности, мера способности атомов химического элемента присоединять электроны (восстанавливаться). Стандартные потенциалы окислительно-восстановительных пар помещены в таблицу.
Чем выше стандартный потенциал окислительно-восстановительной пары, тем выше окислительная активность атомов элемента, тем он — более сильный окислитель
Окислительную активность определяют два фактора:
1) Электроотрицательность . Чем выше электроотрицательность химического элемента, тем выше окислительная активность простого вещества. В Периодической Системе Элементов электроотрицательность растет в сторону правого верхнего угла (слева направо и снизу вверх). Самый сильный окислитель — фтор, на втором месте — кислород.
2) Степень окисления . Чем выше степень окисления атома в составе молекулы или иона, тем ярче проявляется окислительная активность.
Только свойства окислителя проявляют атомы с максимально возможной степенью окисления (она равна номеру группы). Почему? Да, потому что у такого атома на внешнем уровне вообще нет валентных электронов. Ни одного. Все валентные электроны он где-то потерял (отдал кому-то) и остался гол, как сокол (в чем мать родила). Больше отдавать нечего, поэтому можно только присоединять.
У вас часто возникает вопрос — почему при дефиците электронов формируется положительная степень окисления или положительный заряд иона (т.е. почему у окислителя валентные электроны в дефиците или отсутствуют, а его заряд +n)? Да, потому что электроны заряжены отрицательно, а протоны (в ядре) — положительно. В электронейтральном атоме протоны и электроны уравновешены (сколько протонов, столько электронов). Если электроны убрать, то проявятся положительные заряды протонов, которые никуда не деваются в химических реакциях (их можно сдвинуть с насиженного места только ядерными реакциями). Теперь понятно? Если все еще «ежик в тумане» , читайте эту и следующие статьи. Я буду рассматривать все тяжело понимаемые моменты с разных сторон. В конце концов, все станет на свои места и туман рассеется.
Давайте, придумаем образ окислителя. Кто вы, мистер-окислитель? Это — захватчик, завоеватель, грабитель, который скачет на коне и, угрожая, копьем и ружьем, отбирает электроны у восстановителей (часто, отбирает все, что есть). Окислитель не только безжалостный разбойник, но еще и жадина — очень проблематично вернуть назад электроны, которые забрал окислитель. Как только окислитель ограбит восстановителя (заберет у него электроны) он тут же падает вниз по градационной шкале степеней окисления ( «падает в глазах окружающих» ).
Пример сильного окислителя — перманганат-ион. Его часто используют в различных ОВР. Обратите внимание, в зависимости от среды реакции, перманганат-ион образует различные продукты.
Ребята, не слушайте училок-химичек , которые заставляют запоминать продукты ВСЕХ окислительно-восстановительных реакций. Если вы забыли образующиеся вещества и просите помочь, они орут, обзывая вас неучами и и бездельниками. При этом, сами срочно хватают спасательный учебник по химии и пафосно зачитывают вам и всему классу продукты конкретной реакции. Вы задайте этим глупым училкам вопрос — помнят ли они дни рождения всех своих родственников? Что касается меня, то после 16-ти часов работы (такое тоже бывает), я часто забываю номер своего телефона. Но. ЛЮБУЮ ОВР напишу за пару минут (как говорят, темной ночью под кроватью )! Потому, что знаю особые секреты окислительно-восстановительных реакций, которые, между прочим, собираюсь раскрыть моим ученикам и всем моим читателям.
Постепенно, статья за статьей, мы будем изучать технологию написания окислительно-восстановительных реакций, знакомиться с целыми семействами окислителей и восстановителей, их особенностями, характером поведения в разных средах, предполагаемыми продукты. Лукавить не буду, кое-что нам, все-таки, придется запомнить. Совсем немного. Чуть-чуть. Примерно 15 точек, включающих продукты ОВР и основные рекомендации. И вы напишите ЛЮБУЮ окислительно-восстановительную реакцию! В ЛЮБОЙ среде!
Первое задание: запомните три продукта восстановления перманганат-иона (выделено красным цветом) в зависимости от среды протекания окислительно-восстановительной реакции (кислая, нейтральная или щелочная).
Восстановитель — атом в составе молекулы или иона, который отдает электроны окислителю. Происходит процесс окисления восстановителя (его степень окисления повышается).
Восстановительная активность — способность атома отдавать электроны другим атомам.
Восстановительную активность определяют два фактора:
1) Радиус атома . Чем больше радиус атома химического элемента, тем выше восстановительная активность простого вещества. В Периодической Системе Элементов радиус атома увеличивается в сторону левого нижнего угла (справа налево и сверху вниз).
2) Степень окисления . Чем ниже степень окисления атома в составе молекулы или иона, тем ярче проявляется восстановительная активность.
Только свойства восстановителя проявляют атомы с минимально возможной степенью окисления. Для неметаллов она равна «восемь минус номер группы» . Для металлов — ноль. Как только восстановитель отдаст электроны окислителю, он поднимется вверх по градационной шкале степеней окисления ( «растет в глазах окружающих» ).
Посмотрите, как ведет себя сера в роли восстановителя в разных веществах (с разными степенями окисления).
Настало время придумать образ восстановителя. Кто вы, мистер-восстановитель? У меня восстановитель ассоциируется с добрым дедушкой-альтруистом, который одаривает электронами каждого желающего окислителя.
Как же вас различить, господа окислители и восстановители в группе веществ, предложенных для реакций?!
Окислитель можно отыскать по высокой (иногда, максимально высокой) степени окисления, кроме того, мы изучим многие семейные портреты окислителей. Продукты окислителей мы ЗАПОМНИМ (их около 10, не более), кроме того, проведем анализ процесса восстановления окислителя по градационной шкале степеней окисления.
Восстановитель отыщем по низкой (иногда, максимально низкой) степени окисления. Продукт восстановителя будем устанавливать путем анализа с использованием градационных шкал степеней окисления. Хотя. сделаю вам подарок. Читайте мнемоническое стихотворение. Пригодится.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии . Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7 (903) 186-74-55 . Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!



