Видео опыт закон сохранения массы веществ
Видео опыт закон сохранения массы веществ
ХиМуЛя.com

Владельцы сайта
- Галина Пчёлкина

Урок №14. Закон сохранения массы вещества. Химические уравнения
Закон сохранения массы веществ
Проблемный вопрос: изменится ли масса реагирующих веществ по сравнению с массой продуктов реакции?
Чтобы ответить на данный вопрос наблюдайте за следующими видео-экспериментами:
Вывод: Масса веществ до и после реакции не изменилась.
Формулировка закона сохранения массы: масса веществ, вступивших в реакцию, равна массе образовавшихся веществ.
С точки зрения атомно-молекулярного учения этот закон объясняется тем, что при химических реакциях общее количество атомов не изменяется, а происходит лишь их перегруппировка.

Закон сохранения массы веществ является основным законом химии, все расчеты по химическим реакциям производятся на его основе. Именно с открытием этого закона связывают возникновение современной химии как точной науки.
Закон сохранения массы был теоретически открыт в 1748 году и экспериментально подтверждён в 1756 году русским ученым М.В. Ломоносовым.
Французский учёный Антуан Лавуазье в 1789 году окончательно убедил учёный мир в универсальности этого закона. Как Ломоносов, так и Лавуазье пользовались в своих экспериментах очень точными весами. Они нагревали металлы (свинец, олово, и ртуть) в запаянных сосудах и взвешивали исходные вещества и продукты реакции.

Закон сохранения массы веществ применяется при составлении уравнений химических реакций.
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
В результате химического взаимодействия серы и железа получено вещество – сульфид железа ( II ) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Алгоритм составления уравнения химической реакции
Составим уравнение химической реакции взаимодействия фосфора и кислорода
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H 2 ; N 2 ; O 2 ; F 2 ; Cl 2 ; Br 2 ; I 2. Между реагентами ставим знак «+», а затем стрелку:
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов:
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
- Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше.
- В данном случае это атомы кислорода.
- Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
Химические явления. Закон сохранения массы веществ
Урок 26. Химия 8 класс
Конспект урока «Химические явления. Закон сохранения массы веществ»
Химические явления, или химические реакции, отличаются от физических тем, что в результате химических реакций происходит превращение одних веществ в другие. Причем, образовавшиеся вещества отличаются от исходных по своим свойствам. Например, железный гвоздь на воздухе ржавеет, ржавчина – это уже не железо, а совсем другое вещество, отличающееся по свойствам от железа. С химическими явлениями мы встречаемся и в повседневной жизни: скисание молока, гниение листьев, фотосинтез.

Признаки химических реакций: выпадение осадка, выделение газа, появление запаха, выделение или поглощение теплоты, появление света, изменение цвета.

Проследим за протеканием химических реакций и установим признаки, которые подтверждают образование новых веществ и появление у них новых свойств.
Например, при растворении никеля в соляной кислоте, образуется раствор соли изумрудно-зеленого цвета. Образование новых веществ говорит о том, что прошла химическая реакция, признак ее – изменение цвета.

Добавив в раствор сульфида натрия соляной кислоты, появляется запах тухлых яиц. Это запах сероводорода. Признак этой реакции – появление запаха, а образование сероводорода говорит о том, что это химическое явление.
Если к бесцветному раствору йодида калия добавить бесцветный раствор нитрата свинца (II), то образуется две новые соли и выпадает осадок желтого цвета.

Химическое явление можно наблюдать, если кусочек мела бросить в раствор соляной кислоты. При этом наблюдается бурное выделение углекислого газа.
А железный гвоздь, опущенный в раствор соляной кислоты, покрывается пузырьками, эти пузырьки – водород.

Если мы к раствору медного купороса добавим щелочь, то у нас образуется осадок голубого цвета. Прилив к этому осадку раствор кислоты, он раствориться. Эти признаки свидетельствуют о том, что прошла химическая реакция.

Смешаем порошки серы и железа, но новые вещества не образуются, а просто будет смесь веществ, которую можно разделить на компоненты с помощью магнита, или смешав с водой. Под действием магнита, железные опилки притягиваются к нему, а сера нет. При растворении в воде сера всплывает вверх, а железные опилки опустятся вниз. Но если исходную смесь нагреть, то происходит между ними химическая реакция, которая сопровождается выделением большого количества теплоты и образуется новое вещество – FeS – сульфид железа (II). Оно серого цвета, тонет в воде и не притягивается магнитом. Поэтому это явление, горение железных опилок и серы, является химическим.

Если же в ложечке сжечь серу, но она загорится синим пламенем, при этом выделяется теплота и свет, появляется запах жженой серы, эти признаки тоже свидетельствуют о том, что процесс горения серы относится к химическим явлениям.
Реакция горения магния идет очень быстро, он горит ослепительным пламенем с образованием нового вещества – оксида магния. Фосфор тоже сгорает в кислороде с образованием оксида фосфора (V).

Реакции, которые протекают с выделение теплоты и света, называются реакциями горения.
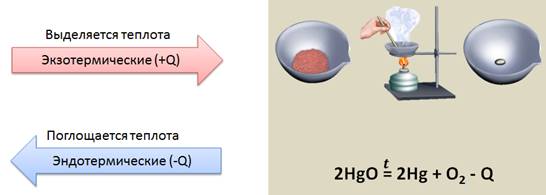
Кроме того, реакции, протекающие с выделением теплоты, называются экзотермическими (экзо – наружу), а реакции, протекающие с поглощением теплоты, называются эндотермическими (эндо – внутрь). К эндотермическим реакциям относится реакция разложения оксида ртути (II). Оксид ртути (II) представляет собой вещество красного цвета. При нагревании образуется кислород, который улетучивается и ртуть – металл серебристо-белого цвета.
Чтобы химическая реакция прошла, необходимы определенные условия:
· Необходимо, чтобы реагирующие вещества соприкоснулись, чем больше будет площадь их соприкосновения, тем быстрее пойдет реакция, для этого твердые вещества измельчают и перемешивают, а растворимые – растворяют и сливают растворы;
· Нагревание – второе условие, которое в основном необходимо для эндотермических реакций, для экзотермических оно необходимо для начала реакции, а в некоторых случаях и вовсе не нужно;
· Некоторые реакции не протекают без света, электрического тока. Например, для процесса фотосинтеза – свет – это необходимое условие.
В 1748 г. М.В. Ломоносов открыл закон сохранения массы веществ, который гласит: масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате ее.
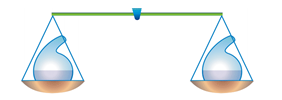
Носителями массы веществ являются атомы химических элементов, из которых состоят как вещества, которые вступают в химическую реакцию (реагенты), так и вещества, образовавшиеся в результате реакции (продукты реакции). При химических реакциях атомы не разрушаются и не образуются, а происходит только их перегруппировка.
Для подтверждения своего закона Ломоносов провел следующий опыт: в специальный сосуд налил соляную кислоту и щелочь – гидроксид натрия. К раствору щелочи налил несколько капель фенолфталеина и раствор щелочи окрасился в малиновый цвет. Закрыл сосуд пробкой, взвесил, а затем слил растворы. При этом окраска малиновая исчезла, т.к. прошла химическая реакция, а масса продуктов реакции оказалась такой же, как и исходная.
Подтверждение закона сохранения массы веществ

Мы можем сами доказать справедливость этого закона. Уравновесим на весах колбу с раствором хлорида железа (III), в которую опущена пробирка с гидроксидом натрия. Взвесим колбу. Смешаем растворы, у нас появляется осадок бурого цвета – гидроксид железа (III). Появление осадка говорит о том, что прошла химическая реакция. Взвесим колбу снова и видим, что масса не изменилась.
Закон сохранения массы веществ является основным законом химии. На основании этого закона составляют уравнения химических реакций и проводят расчеты по уравнениям.
Сущность химической реакции. Закон сохранения массы веществ
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти

Из данного урока вы узнаете, в чем заключается сущность химической реакции с позиции атомно-молекулярной теории. Урок посвящен изучению одного из важнейших законов химии – закона сохранения массы веществ.
Тема: Первоначальные химические представления
Урок: Сущность химической реакции. Закон сохранения массы веществ
1. Сущность химической реакции с позиции атомно-молекулярной теории
Вопрос о сущности химического превращения долгое время оставался загадкой для естествоиспытателей. Только с развитием атомно-молекулярной теории стало возможным предположить, как на уровне атомов и молекул происходят химические реакции.
В соответствие с атомно-молекулярной теорией, вещества состоят из молекул, а молекулы – из атомов. В ходе химической реакции атомы, входящие в состав исходных веществ, не исчезают и не появляются новые атомы.
Тогда, мы можем предположить, что в результате химической реакции продукты реакции образуются из атомов, которые ранее входили в состав исходных веществ. Вот модель химической реакции:

Рис. 1. Модель химической реакции с позиции АМТ
Проанализировав данную модель, мы можем выдвинуть гипотезу (научно обоснованное предположение):
Суммарная масса продуктов реакции должна быть равна суммарной массе исходных веществ.
Еще Леонардо да Винчи сказал: «Знания, не проверенные опытом, матерью всякой достоверности, бесплодны и полны ошибок». Значит, гипотеза никогда не станет законом, если ее не подтвердить экспериментально.
Экспериментальный метод в химии начал широко использоваться после исследований Р. Бойля в 17 в. Английский естествоиспытатель прокаливал металлы в незапаянных сосудах – ретортах и обнаружил, что после прокаливания масса металла становилась больше.
Основываясь на этих опытах, он не учитывал роль воздуха и сделал неправильный вывод, что масса веществ в ходе химических реакций изменяется.
М.В. Ломоносов, в отличие от Р. Бойля, прокаливал металлы не на открытом воздухе, а в запаянных ретортах и взвешивал их до и после прокаливания. Он доказал, что масса веществ до и после реакции остается неизменной и что при прокаливании к металлу присоединяется воздух (кислород в то время не был еще открыт). Но Ломоносов не опубликовал результаты своих исследований.
В 1774 г. опыты Р. Бойля повторил А. Лавуазье с совершенно такими же результатами, как и Ломоносов. Но он сделал новое, очень важное, наблюдение, а именно, что только часть воздуха запаянной реторты соединилась с металлом и что увеличение веса металла, перешедшего в окалину, равно уменьшению веса воздуха в реторте. Вместе с тем часть металла осталась в свободном виде.
Таким образом, независимо друг от друга, М.В. Ломоносов и А. Лавуазье подтвердили справедливость предположения о сохранении массы веществ в результате химической реакции.
2. Открытие закона сохранения массы веществ
Это предположение стало законом лишь после десятилетнего исследования немецкого химика Г. Ландольта в начале 20 века. Сегодня закон сохранения массы веществ формулируется так:
Масса веществ, участвующих в реакции, равна массе продуктов реакции.
Подтвердить правильность закона сохранения массы веществ можно с помощью следующего опыта. В первом сосуде Ландольта подготовим растворы йодида калия и нитрата свинца. Во втором сосуде – пройдет реакция хлорида железа с роданидом калия. Плотно закрываем пробки. Уравновешиваем чашки весов. Сохранится ли равновесие после окончания реакций? В первом сосуде выпадает желтый осадок йодида свинца, во втором образуется темно-красный роданид трехвалентного железа. В сосудах Ландольта произошли химические реакции: образовались новые вещества. Но равновесие не нарушилось (Рис. 2). Масса исходных веществ всегда равна массе продуктов реакции.

Рис. 2. Эксперимент, подтверждающий правильность закона сохранения массы веществ
3. Опыты, иллюстрирующие закон сохранения массы веществ
Приведем пример еще одного опыта, доказывающего правильность закона сохранения массы веществ в химических реакциях. Внутри колбы при закрытой пробке будет гореть свеча. Уравновесим весы. Подожжем свечу и опустим ее в колбу. Плотно закроем колбу пробкой. Горение свечи – это химический процесс. Израсходовав находящийся в колбе кислород, свеча гаснет, химическая реакция завершается. Но равновесие весов не нарушается: масса продуктов реакции остается такой же, какой была масса исходных веществ (Рис. 3).

Рис. 3. Эксперимент с горящей свечой в колбе
Открытие закона сохранения массы веществ имело огромное значение для дальнейшего развития химии. На основании закона сохранения массы веществ производят важнейшие расчеты и составляют уравнения химических реакций.
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.15-16)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§6)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2016. (§18-19).
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
1. Единая коллекция цифровых образовательных ресурсов (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
3. Тесты по химии (онлайн) (Источник).
с. 16 №№ 3,5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 

Химические явления. Закон сохранения массы веществ
Урок 26. Химия 8 класс
Конспект урока «Химические явления. Закон сохранения массы веществ»
Химические явления, или химические реакции, отличаются от физических тем, что в результате химических реакций происходит превращение одних веществ в другие. Причем, образовавшиеся вещества отличаются от исходных по своим свойствам. Например, железный гвоздь на воздухе ржавеет, ржавчина – это уже не железо, а совсем другое вещество, отличающееся по свойствам от железа. С химическими явлениями мы встречаемся и в повседневной жизни: скисание молока, гниение листьев, фотосинтез.

Признаки химических реакций: выпадение осадка, выделение газа, появление запаха, выделение или поглощение теплоты, появление света, изменение цвета.

Проследим за протеканием химических реакций и установим признаки, которые подтверждают образование новых веществ и появление у них новых свойств.
Например, при растворении никеля в соляной кислоте, образуется раствор соли изумрудно-зеленого цвета. Образование новых веществ говорит о том, что прошла химическая реакция, признак ее – изменение цвета.

Добавив в раствор сульфида натрия соляной кислоты, появляется запах тухлых яиц. Это запах сероводорода. Признак этой реакции – появление запаха, а образование сероводорода говорит о том, что это химическое явление.
Если к бесцветному раствору йодида калия добавить бесцветный раствор нитрата свинца (II), то образуется две новые соли и выпадает осадок желтого цвета.

Химическое явление можно наблюдать, если кусочек мела бросить в раствор соляной кислоты. При этом наблюдается бурное выделение углекислого газа.

А железный гвоздь, опущенный в раствор соляной кислоты, покрывается пузырьками, эти пузырьки – водород.

Если мы к раствору медного купороса добавим щелочь, то у нас образуется осадок голубого цвета. Прилив к этому осадку раствор кислоты, он раствориться. Эти признаки свидетельствуют о том, что прошла химическая реакция.

Смешаем порошки серы и железа, но новые вещества не образуются, а просто будет смесь веществ, которую можно разделить на компоненты с помощью магнита, или смешав с водой. Под действием магнита, железные опилки притягиваются к нему, а сера нет. При растворении в воде сера всплывает вверх, а железные опилки опустятся вниз. Но если исходную смесь нагреть, то происходит между ними химическая реакция, которая сопровождается выделением большого количества теплоты и образуется новое вещество – FeS – сульфид железа (II). Оно серого цвета, тонет в воде и не притягивается магнитом. Поэтому это явление, горение железных опилок и серы, является химическим.

Если же в ложечке сжечь серу, но она загорится синим пламенем, при этом выделяется теплота и свет, появляется запах жженой серы, эти признаки тоже свидетельствуют о том, что процесс горения серы относится к химическим явлениям.
Реакция горения магния идет очень быстро, он горит ослепительным пламенем с образованием нового вещества – оксида магния. Фосфор тоже сгорает в кислороде с образованием оксида фосфора (V).

Реакции, которые протекают с выделение теплоты и света, называются реакциями горения.
Кроме того, реакции, протекающие с выделением теплоты, называются экзотермическими (экзо – наружу), а реакции, протекающие с поглощением теплоты, называются эндотермическими (эндо – внутрь). К эндотермическим реакциям относится реакция разложения оксида ртути (II). Оксид ртути (II) представляет собой вещество красного цвета. При нагревании образуется кислород, который улетучивается и ртуть – металл серебристо-белого цвета.

Чтобы химическая реакция прошла, необходимы определенные условия:
· Необходимо, чтобы реагирующие вещества соприкоснулись, чем больше будет площадь их соприкосновения, тем быстрее пойдет реакция, для этого твердые вещества измельчают и перемешивают, а растворимые – растворяют и сливают растворы;
· Нагревание – второе условие, которое в основном необходимо для эндотермических реакций, для экзотермических оно необходимо для начала реакции, а в некоторых случаях и вовсе не нужно;
· Некоторые реакции не протекают без света, электрического тока. Например, для процесса фотосинтеза – свет – это необходимое условие.
В 1748 г. М.В. Ломоносов открыл закон сохранения массы веществ, который гласит: масса веществ, вступивших в химическую реакцию, равна массе веществ, получившихся в результате ее.

Носителями массы веществ являются атомы химических элементов, из которых состоят как вещества, которые вступают в химическую реакцию (реагенты), так и вещества, образовавшиеся в результате реакции (продукты реакции). При химических реакциях атомы не разрушаются и не образуются, а происходит только их перегруппировка.
Для подтверждения своего закона Ломоносов провел следующий опыт: в специальный сосуд налил соляную кислоту и щелочь – гидроксид натрия. К раствору щелочи налил несколько капель фенолфталеина и раствор щелочи окрасился в малиновый цвет. Закрыл сосуд пробкой, взвесил, а затем слил растворы. При этом окраска малиновая исчезла, т.к. прошла химическая реакция, а масса продуктов реакции оказалась такой же, как и исходная.
Подтверждение закона сохранения массы веществ

Мы можем сами доказать справедливость этого закона. Уравновесим на весах колбу с раствором хлорида железа (III), в которую опущена пробирка с гидроксидом натрия. Взвесим колбу. Смешаем растворы, у нас появляется осадок бурого цвета – гидроксид железа (III). Появление осадка говорит о том, что прошла химическая реакция. Взвесим колбу снова и видим, что масса не изменилась.
Закон сохранения массы веществ является основным законом химии. На основании этого закона составляют уравнения химических реакций и проводят расчеты по уравнениям.



