Видео признаки химических реакций
Признаки химических реакций
Урок 21. Химия. Вводный курс. 7 класс
Конспект урока «Признаки химических реакций»
Химические реакции – это превращения одних веществ в другие, которые сопровождаются явлениями, называемыми признаками химических реакций.
Основными признаки химических реакций являются:
· выделение или поглощение теплоты;
· выпадение и растворение осадка.
Рассмотрим каждый из этих признаков.
Например, в стакане находится бесцветный раствор щёлочи. Обнаружить его можно с помощью веществ, которые называются индикаторами. Индикатор (от латинского indication) означает «указатель». Добавим в стакан со щёлочью спиртовой раствор фенолфталеина, который является в данном случае индикатором. При этом раствор становится малинового цвета, значит, в стакане была щёлочь. Затем прильём к содержимому раствор кислоты. Постепенно малиновая окраска исчезает. В данном опыте мы наблюдали такой признак химической реакции, как изменение цвета.

Рассмотрим ещё один опыт, в ходе которого происходит изменение цвета раствора. В одном стакане у нас находится фиолетово-розовый раствор, который представляет собой раствор перманганата калия в щелочной среде, а во втором стакане – оранжевый раствор, который представляет собой подкисленный раствор дихромата калия. Добавляем в каждый стакан бесцветный раствор сульфита натрия. В первом стакане раствор становится зелёного цвета, во втором – также приобретает зелёную окраску.
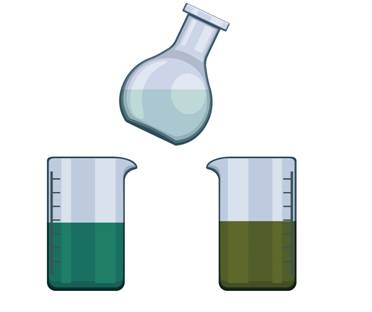
В стакан с водой добавим несколько кристалликов перманганата калия, а затем сюда же поместим таблетку аскорбиновой кислоты. Перемешаем всё. Раствор становится бесцветным. Во всех этих опытах мы наблюдали изменение цвета.

В газовых зажигалках можно увидеть бесцветную жидкость, которая является смесью двух газов: пропана и бутана. Здесь они в жидком состоянии, потому что находятся под высоким давлением. Если нажать на кнопку зажигалки, послышится характерное шипение – это газы вырываются наружу. Происходит реакция горения пропана и бутана.

Таким образом, переход пропана и бутана в жидкое состояние – это физическое явление, а горение этих газов – химическое. В данном эксперименте мы наблюдали выделение света и тепла – это также признаки химических реакций.
Рассмотрим ещё один признак химической реакции – образование и растворение осадка. В два химических стакана, содержащих бесцветный раствор гидроксида натрия и желтоватый раствор жёлтой кровяной соли, добавим раствор хлорида железа. В первом стакане образуется осадок бурого цвета, а во втором – осадок синего цвета.

Если в первый стакан с бурым осадком добавить соляную кислоту, то осадок начинает растворяться.
Благодаря образованию нерастворимого вещества карбоната кальция в результате химических превращений в пещерах растут сталактиты и сталагмиты. Такие процессы длятся тысячелетиями.

Рассмотрим ещё один признак химической реакции – образование газа. В пробирку с кусочками мрамора добавим соляной кислоты. Происходит бурное выделение пузырьков газа.
Признаки Химической Реакции
Для просмотра онлайн кликните на видео ⤵

4. Химическая реакция и ее признаки Подробнее

Опыты по химии. Признаки химических реакций Подробнее

Признаки химических реакций. Химические и физические явления. Подробнее

ОГЭ химия. Задания на признаки химических реакций. Подробнее

Химия. 7 класс. Признаки химических реакций. Подробнее

Определение признаков химических реакций Подробнее

Химия 8 класс (Урок№3 — Физические и химические явления. Признаки химических реакций.) Подробнее

Практическая работа 3. Изучение признаков химических реакций и условий их протекания Подробнее

Химичим на уроке. Признаки химических реакций (ОГЭ) Подробнее

Химические реакции. Химия 8 класс Подробнее

Признаки химических реакций. Химия 8 класс. Подробнее

Химические уравнения. Как составлять химические уравнения. Подробнее

Химия — просто. Урок 1 «ПСЭ» Подробнее

Расстановка коэффициентов в химических реакциях: как просто это сделать Подробнее

25 КРУТЫХ, УДИВИТЕЛЬНЫХ ХИМИЧЕСКИХ РЕАКЦИЙ И ОПЫТОВ Подробнее

Расстановка коэффициентов в химическом уравнении Подробнее

7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ ДЛЯ ДОМА! Подробнее

Химический вулкан и огненная метель с оксидом хрома! Подробнее

Составление уравнений химических реакций Подробнее
Признаки Химической Реакции
Для просмотра онлайн кликните на видео ⤵

Опыты по химии. Признаки химических реакций Подробнее

4. Химическая реакция и ее признаки Подробнее

Признаки химических реакций. Химические и физические явления. Подробнее

ОГЭ химия. Задания на признаки химических реакций. Подробнее

Химия. 7 класс. Признаки химических реакций. Подробнее

Практическая работа 3. Изучение признаков химических реакций и условий их протекания Подробнее

Химия 8 класс (Урок№3 — Физические и химические явления. Признаки химических реакций.) Подробнее

Определение признаков химических реакций Подробнее

Признаки химических реакций. Химия 8 класс. Подробнее

Химические реакции. Химия 8 класс Подробнее

Практическая работа Признаки химических реакций Подробнее

Химические уравнения. Как составлять химические уравнения. Подробнее

Химия — просто. Урок 1 «ПСЭ» Подробнее

Расстановка коэффициентов в химических реакциях: как просто это сделать Подробнее

25 КРУТЫХ, УДИВИТЕЛЬНЫХ ХИМИЧЕСКИХ РЕАКЦИЙ И ОПЫТОВ Подробнее

Расстановка коэффициентов в химическом уравнении Подробнее

7 ПРОСТЫХ ХИМИЧЕСКИХ ОПЫТОВ ДЛЯ ДОМА! Подробнее

Химический вулкан и огненная метель с оксидом хрома! Подробнее

Составление уравнений химических реакций Подробнее
Характеристика химических реакций
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти

Мир химических реакций очень разнообразен, чтобы в нем ориентироваться, необходимо научиться характеризовать химические реакции. Данный урок посвящен изучению условий начала, условий протекания и признаков химических процессов. Вы научитесь давать характеристику химической реакции, определять тип реакций соединения и разложения по количеству исходных веществ и продуктов реакции.
Тема: Первоначальные химические представления
Урок: Характеристика химических реакций
1. Многообразие химических реакций, план характеристики
Химические реакции очень разнообразны: одни протекают с выделением большого количества энергии в виде тепла и света (Рис. 1), другие сопровождаются выделением газа, изменением цвета (Рис. 2).

Рис. 1. Горение магния

Рис. 2. Взаимодействие меди с концентрированной азотной кислотой
Чтобы охарактеризовать химическую реакцию, необходимо описать ее отличительные особенности. Принято указывать условия начала, условия течения и признаки реакции. Охарактеризуем примеры реакций горения магния и взаимодействия меди с концентрированной азотной кислотой по приведенным пунктам.
2. Условия начала реакции
К условиям начала химической реакции относят то, что следует осуществить для того, чтобы реакция начала протекать. Часто для начала реакции необходимо соприкосновение исходных веществ.
Так и в случае реакции азотной кислоты с медью для ее начала достаточно, чтобы реагирующие вещества соприкасались друг с другом. Однако одного соприкосновения реагирующих веществ нередко бывает недостаточно.
Например, магний начинает гореть не просто при соприкосновении с кислородом, содержащимся в воздухе. Для того чтобы эта реакция начала протекать, кусочек магния нужно поджечь.
Итак, мы видим, что химическая реакция начинается при определенных условиях. Если эти условия не выполняются, то химическое превращение невозможно. Для продолжения протекания реакции тоже нужно создать определенные условия.
3. Условия течения реакции
Например, условием протекания реакции горения магния является постоянный приток воздуха. Если приток воздуха прекратить, то горение тоже прекратится, т.к. магний перестанет соприкасаться с кислородом.
Химическая реакция между азотной кислотой и медью будет продолжать протекать, если вещества будут соприкасаться друг с другом и дальше. Значит, если из колбы вынуть кусочек меди, то химический процесс прекратится.
4. Признаки реакции
Продукты химической реакции – вещества, обладающие иными свойствами по сравнению с исходными веществами, поэтому об их образовании можно судить по ряду признаков. К признакам химической реакции относят выделение газа, выпадение осадка, изменение цвета и запаха, выделение света и теплоты.
Рассмотрим признаки рассматриваемых нами реакций. О протекании реакции горения магния можно судить по выделению большого количества света и тепла. Кроме того, серый металл магний превратился в белый оксид магния, т.е. произошло изменение цвета.
При взаимодействии концентрированной азотной кислоты с медью происходит выделение бурого газа и изменение цвета раствора.
5. Типы реакций — соединение и разложение
Иногда в характеристике химической реакции указывают ее тип.
В рамках данного урока рассматриваются только два типа реакций: реакции соединения и реакции разложения. В результате горения магния из двух веществ (магния и кислорода) образуется одно вещество – оксид магния. Такую реакцию относят к реакциям соединения.
Реакция соединения – это процесс, в результате которого из двух или более веществ получается одно вещество.
Противоположным процессом является реакция разложения.
Реакция разложения – это процесс, в результате которого из одного вещества получаются два или более новых веществ.
Примером реакции разложения может служить разложение воды. Под действием электрического тока вода разлагается на два газообразных вещества – кислород и водород.
Список рекомендованной литературы
1. Сборник задач и упражнений по химии: 8-й класс: к учебнику П.А. Оржековского и др. «Химия, 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. – М.: АСТ: Астрель, 2006.
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006. (с.11-15)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§5)
4. Химия: неорг. химия: учеб. для 8 кл. общеобр. учреждений / Г.Е. Рудзитис, ФюГю Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§3)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
1. Единая коллекция цифровых образовательных ресурсов (Источник).
2. Электронная версия журнала «Химия и жизнь» (Источник).
3. Тесты по химии (онлайн) (Источник).
с.12-14 №№2-5,7 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского — М.: АСТ: Астрель: Профиздат, 2006.
Если вы нашли ошибку или неработающую ссылку, пожалуйста, сообщите нам – сделайте свой вклад в развитие проекта. 




